Химиядан өзіндік жұмыстардың түрлері
І. Есептер мен тапсырмалар
1. Мына мәліметтер нені білдіреді:
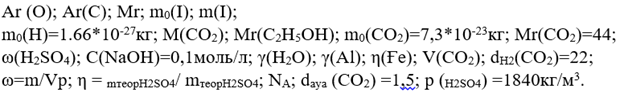
2. Тиісті таңбалар бойынша белгілеу:
а) салыстырмалы кальций атомының массасы.
б) кальцийдің мольдік массасы, кальций ионының молярлық массасы.
3. Келесі таңбалар нені білдіреді:
а) Mr(CH3COOH); M(CH3COOH)г/моль ; m(CH3COOH); mM(CH3COOH);
б) ω(S)=(Н2SО4); ω(Н)=(СН4); аммиак шығымының массалық үлесі η(NН3)=30%;
в) V(С3Н6); Vm(С2Н2).
4. Элементтердің массалық үлесін анықтаңыз: H2SO4 (ω(H); ω(S); ω(O) -? ω(NaOH) -? ω(NH4NO3) -?)
5. Келесі өлшемдердің айырмашылықтары мен ұқсастықтары қандай: оттегі атомының массасы, оттегінің салыстырмалы атомдық массасы, оттегі молекуласының салыстырмалы массасы, оттегі атомының молярлық массасы, оттегінің массасы. Оларды арнайы таңбалармен өрнектеңіз.
6. №5-80, №5-84, №5-111, №11-86 есептерін талдаңыз. Жоспар жасаңыз.
7. Тек кристалдық сода алу үшін, зертханада қанша су алу керек.
8. 700 г 14,2% Na2SO4 ерітіндісін дайындау үшін Глаубердің қанша тұзы мен суы қажет?
Өзіндік жұмысқа арналған есептер.
Есеп №1. 2,17 г HgO ыдырау кезінде 0,16 г оттегі бөлінеді. Реакция нәтижесінде қанша грамм сынап пайда болды. Айта кету керек, бұл реакцияда басқа заттар түзілмейді.
Есеп №2. 4 г күкірт 7 г Fe-мен қалдықсыз әрекеттеседі. FeS массасы қандай? Осы есептерді шеше отырып, олар реакциядан кейінгі заттардың массасын есте сақтауды, массаның сақталу заңы негізінде есептеуді үйренеді.
Авогадро заңы қабылданған кезде келесі есепті шығаруға болады.
Есеп №1. 14 г азот, 16 г оттегі, 17 г аммиак (қ.ж) көлемі неше болады?
Есеп № 2. Көлемі 1 м3 (қ.ж) газдың заттық мөлшері қандай?
Есеп №3. 1 г CaCO3 термиялық ыдырау кезінде (қ.ж) неше көлем CO2 бөлінеді?
Есеп № 4. 1 л газ (қ.ж.) 1,25 г-ға тең. Газдың салыстырмалы молекулалық салмағы неше болады?
Есеп № 5. 1 моль H2, O2 CO2 көлемін табыңыз, егер олардың p(H2) = 0,089 г/л, p(O2) = 1,43 г/л болса, p(CO2) = 1,96 г/л.
Шешім: Формула бойынша V=m/p есептейді, «т» орнына «М» -ге ауыстырылады, өйткені 1 моль заттың массасы моль массасына тең:
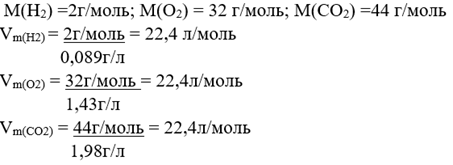
Алынған ақпараттан оқушылар молярлық көлем 22,4 литр екенін біледі, содан кейін мұғалім Авогадро заңын бір көлемдегі әртүрлі газдардың молекулаларының саны бірдей деп түсіндіреді. Моль ұғымын түсіндіру үшін мұғалім алдымен мәселені анықтайды.
Есеп №6. 1 мольге қанша бөлшек сан кіреді?
Мысалы: көміртек атомы 12 г және оттегі молекуласы 32 г бөлшектердің саны қанша?
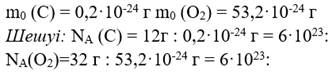
Осыдан оқушылар қорытынды шығарып, кез-келген 1 моль 6*1023 тең екенін анықтайды.
Жаңа сабақты түсіндіру кезінде мұғалім оқушыларды тек кейбір есептеулерге тарта отырып, проблеманы талқылайды. Тапсырмаларды жаңа сабақтағыдай, химиялық жаттығулар сияқты беруге болады, тек осы жағдайда мұғалім оқушылардан мәселені өз бетімен талқылауды талап етеді. Растау ретінде, егер оқушылар есепті шешуге шебер болса, мұғалім одан да қиын мәселелерді шешуге береді. Мысалы: Массаның сақталу заңы және Авагадро заңы келесі есептерді қоюға мүмкіндік береді:
Есеп № 1. 20 г CaCO3 тұрақты салмаққа дейін қыздырғанда 10,12 г CaO алынған. Шығарылған СО2 массасын табыңыз.
Есеп № 2. 2,7 г суды толықтай сутегі мен оттегіге ыдырауы барысында 0,3 г сутек береді. Өндірілген оттегінің массасы қандай?
Есеп № 3. Егер газдың көлемі 250 мл, ал оның массасы 0,715 г (г-мен) болса. Оның салыстырмалы молекулалық салмағы қандай?
Есеп №4. 0,2 моль O2, 0,2 моль H2 (салыстырмалы ылғалдылық) көлемі қандай?
Есеп № 5. 7 г N2; 5,1 г NH3; 6,8 г H2S көлемі қандай?
Алынған білімді сандық, эксперименттік есептер, химиялық реакциялар теңдеулерін жазу үшін де қолдануға болады. Сабақ барысында білімді тексеру кезінде үйге тапсырған (есепті) шығартуға болады. Ол алдымен есептің дұрыстығын тексереді. Мұғалім оқушыны тақтаға шығарып, тапсырмаларды кітабінен алып шығаруға ұсынады. Егер оның көшірілгені белгілі болса, ұқсас есеп жасауды ұсынады. Сонымен бірге оқушы проблеманы талқылайды, ережелерін түсіндіреді және оны әртүрлі тәсілдермен шешуге тырысады. Егер мәселе күрделі болса, оны сыныппен талқылау керек. Сандық есептерді қайталау және қорытынды сабақтарда қолдануға болады. Бұл жағдайда есеп 2-3 мазмұны аралас үлгілерден тұратындай етіп жасалады. Бұл әдіс жоғарғы сыныпта қолданылады.
Мысалы; Авагадро заңымен байланысты тұжырымдау үшін массаның сақталу заңын, Авагадро заңына сәйкес есептеулерде көрініс табуы керек.
Есеп №1. Fe3O4 тотықсыздандырғанда темірдің 11,2 литр сутегімен реакциясына қанша Fe3O4 қатысады?
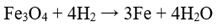
Есеп №2. Мырышты HCl-мен әрекеттестіру арқылы 4,48 литр сутек алынды. Реакцияға қанша мырыш қатысты?
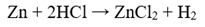
Бұл мысалда массаның сақталу заңы және Авагадро заңы көрсетілген.
 using WordPress and
using WordPress and